Bamlanivimab ed etesevimab di Lilly insieme hanno ridotto i ricoveri e i decessi nello studio di fase 3 per COVID-19 di recente diagnosi
• Nuovi dati mostrano che la terapia ha ridotto il rischio di ricoveri e morte dell'87%
• Secondo risultato positivo dello studio di Fase 3 per bamlanivimab ed etesevimab insieme
• I risultati supportano l’utilizzo di bamlanivimab 700 mg ed etesevimab 1400 mg, la dose autorizzata negli Stati Uniti e in diversi paesi in tutto il mondo
INDIANAPOLIS, 10 Marzo 2021 – Eli Lilly and Company ha annunciato oggi nuovi dati dallo studio di fase 3 randomizzato, in doppio cieco, controllato con placebo, BLAZE-1, che dimostra che bamlanivimab (LY-CoV555) 700 mg ed etesevimab (LY-CoV016) 1400 mg insieme hanno ridotto significativamente i ricoveri e i decessi correlati a COVID-19 ("eventi") in pazienti ad alto rischio e con recente diagnosi di COVID-19. Questi risultati forniscono ulteriori dati sull'efficacia e sulla sicurezza che supportano l'utilizzo del dosaggio che recentemente ha avuto l'autorizzazione per l'uso di emergenza dalla Food and Drug Administration (FDA) degli Stati Uniti oltre che il parere scientifico positivo da parte del Committee for Medicinal Products for Human (CHMP) dell'Agenzia europea dei medicinali (EMA).
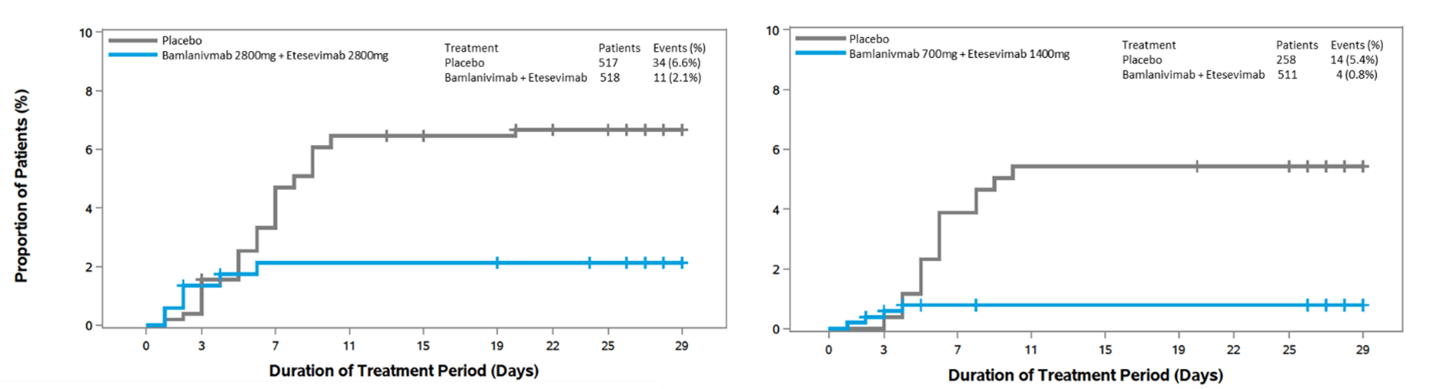
Questa nuova coorte di dati di Fase 3 di BLAZE-1 comprendeva 769 pazienti ad alto rischio, di età pari o superiore a 12 anni con COVID-19 da lieve a moderato (terapia: n = 511; placebo: n = 258). Ci sono stati quattro eventi in pazienti che assumevano bamlanivimab con etesevimab e 15 eventi in pazienti che assumevano placebo, che rappresentano una riduzione del rischio dell'87% (p <0,0001). Bamlanivimab ed etesevimab insieme hanno anche dimostrato miglioramenti statisticamente significativi sugli endpoint secondari chiave. Questi risultati sono coerenti con quelli osservati in altri set di dati di BLAZE-1: nella precedente coorte di Fase 3, bamlanivimab 2800 mg con etesevimab 2800 mg hanno ridotto il rischio di ricoveri e decessi del 70% e nella coorte di Fase 2, bamlanivimab da solo ha ridotto il rischio di ricoveri e accessi in pronto soccorso di circa il 70 per cento. Anche le riduzioni della carica virale sono coerenti con quanto osservato nella precedente coorte di Fase 3 dello studio.
In questa nuova coorte di Fase 3, si sono verificati quattro decessi totali, tutti ritenuti correlati a COVID-19 e tutti avvenuti in pazienti che assumevano placebo; non si sono verificati decessi nei pazienti che ricevevano il trattamento con bamlanivimab ed etesevimab insieme. Nelle due coorti di Fase 3 dello studio che sono state analizzate fino ad oggi, non si sono verificati decessi nei pazienti che ricevevano il trattamento con bamlanivimab ed etesevimab insieme e 14 decessi nei pazienti che ricevevano placebo, 13 dei quali sono stati considerati correlati a COVID-19. In questo set di dati, il profilo di sicurezza di bamlanivimab ed etesevimab insieme è stato coerente gli altri studi di Fase 1, Fase 2 e Fase 3 che valutavano questi anticorpi.
Figura 1: Tempo per il ricovero correlato a COVID-19
“Questi risultati positivi rafforzano i risultati precedenti e supportano l’utilizzo della dose autorizzata di bamlanivimab 700 mg con etesevimab 1400 mg. Questi dati - oltre alla recente EUA della FDA, alla decisione del CHMP dell'EMA e alla raccomandazione per la terapia nelle linee guida sul trattamento COVID-19 del National Institutes of Health - forniscono agli operatori sanitari ulteriori informazioni sull'uso congiunto di bamlanivimab ed etesevimab come un trattamento potenzialmente salvavita per aiutare le persone più a rischio di gravi complicanze del COVID-19 ", ha affermato Daniel Skovronsky, MD, Ph.D., chief scientific officer di Lilly e presidente dei Lilly Research Laboratories. "I risultati coerenti osservati in più coorti di questo studio per diversi mesi, anche se sono emersi nuovi ceppi di COVID-19, indicano che bamlanivimab con etesevimab mantengono i loro effetti contro una serie di varianti, in particolare quelle circolanti negli Stati Uniti"
Lilly continua a collaborare con le autorità regolatorie globali per rendere disponibili in tutto il mondo bamlanivimab da solo e bamlanivimab ed etesevimab insieme. Bamlanivimab da solo e bamlanivimab con etesevimab insieme sono autorizzati in percorsi speciali / di emergenza, nel contesto della pandemia, negli Stati Uniti e nell'Unione Europea. Inoltre, il solo bamlanivimab è autorizzato per l'uso di emergenza in Canada, Panama, Kuwait, Emirati Arabi Uniti, Israele, Ruanda, Marocco e numerosi altri paesi. Grazie al lavoro di Lilly con la Bill & Melinda Gates Foundation, Lilly fornisce gratuitamente dosi di bamlanivimab in Ruanda e Marocco.
Informazioni su bamlanivimab
Bamlanivimab è un anticorpo monoclonale ricombinante, neutralizzante IgG1 (Mab) diretto contro la proteina spike di SARS-CoV-2. E’ progettato per bloccare la carica virale e l'ingresso nelle cellule umane, neutralizzando così il virus, potenzialmente trattando il COVID-19. Bamlanivimab è nato dalla collaborazione tra Lilly e AbCellera per creare terapie anticorpali per la prevenzione e il trattamento del COVID-19. I ricercatori della Lilly rapidamente hanno sviluppato l’anticorpo in meno di 3 mesi dalla sua scoperta da parte di AbCellera e dei ricercatori presso il National Institute of Allergy and Infectious Diseases (NIAID) Vaccine Research Center. L’anticorpo è stato identificato da un campione di sangue di uno dei primi pazienti americani guariti da COVID-19.
Lilly ha completato con successo studio di fase 1 su pazienti ricoverati con COVID-19 (ClinicalTrials.gov: NCT04411628). E’ anche in corso in ambiente ambulatoriale uno studio di Fase 2/3 in persone a cui è stata recentemente diagnosticato il COVID-19 (BLAZE-1, ClinicalTrials.gov: NCT04427501). Lo studio di Fase 3 per la prevenzione del COVID-19 nei residenti e nel personale delle strutture di assistenza di lunga degenza (BLAZE-2, ClinicalTrials.gov: NCT04497987) è in corso. Inoltre, Bamlanivimab è testato nello studio ACTIV-2 condotto dall’NIH (National Institute of Health) in pazienti ambulatoriali affetti da COVID-19.
Informazioni su etesevimab
Etesevimab (LY-CoV016, noto anche come JS016) è un anticorpo monoclonale neutralizzante completamente umano ricombinante, che si lega specificamente al dominio di legame del recettore della proteina spike di superficie di SARS-CoV-2 con alta affinità e può bloccare il legame del virus con il recettore ACE2 sulla superficie della cellula ospite. Mutazioni puntiformi sono state introdotte nell'anticorpo IgG1 umano nativo per mitigare la funzione effettrice. Lilly ha ottenuto la licenza per etesevimab da Junshi Biosciences dopo che è stato sviluppato congiuntamente da Junshi Biosciences e Institute of Microbiology, Chinese Academy of Science (IMCAS). Junshi Biosciences guida lo sviluppo in Cina, mentre Lilly guida lo sviluppo nel resto del mondo.
Lilly ha completato con successo uno studio di Fase 1 (ClinicalTrials.gov: NCT04441931) su etesevimab in volontari statunitensi sani per valutare la sicurezza, la tollerabilità, la farmacocinetica e l'immunogenicità. È in corso uno studio di fase 2/3 su persone a cui è stato recentemente diagnosticato COVID-19 in ambito ambulatoriale (BLAZE-1, ClinicalTrials.gov: NCT04427501). Junshi Biosciences ha completato uno studio simile di Fase 1 su volontari sani in Cina e ha avviato studi di Fase 1b / 2 su pazienti COVID-19 a livello globale.
Lo Studio BLAZE-1
BLAZE-1 (ClinicalTrials.gov: NCT04427501) è uno studio di fase 2/3 randomizzato, in doppio cieco, controllato con placebo, progettato per valutare l'efficacia e la sicurezza di bamlanivimab da solo o di bamlanivimab ed etesevimab insieme per il trattamento del COVID-19 sintomatico in regime ambulatoriale. Per essere eleggibili, i pazienti dovevano presentare sintomi lievi o moderati di COVID-19 e un test SARS-CoV-2 positivo sulla base di un campione raccolto non più di tre giorni prima dell'infusione del farmaco.
Nella porzione di Fase 2 di BLAZE-1, coorti di pazienti con COVID-19 da lieve a moderata di recente diagnosi, sono state randomizzate a una delle tre dosi di bamlanivimab (700 mg, 2800 mg e 7000 mg), bamlanivimab 2800 mg più etesevimab 2800 mg o placebo. I risultati delle coorti di Fase 2 di BLAZE-1 sono stati pubblicati nel New England Journal of Medicine e nel The Journal of the American Medical Association.
Nella porzione di Fase 3 di BLAZE-1, i bracci della terapia di combinazione hanno arruolato pazienti COVID-19 da lievi a moderati, di recente diagnosi, ad alto rischio di progressione a COVID-19 grave e / o ospedalizzazione, studiando bamlanivimab 2800 mg più etesevimab 2800 mg rispetto al placebo. L’endpoint primario per la parte di fase 3 dello studio BLAZE-1 era la percentuale di partecipanti che hanno subito ricoveri correlati a COVID o morte per qualsiasi causa entro il giorno 29. Gli endpoint secondari chiave erano il cambiamento dal basale al giorno 7 in SARS-CoV -2 carica virale, carica virale SARS-CoV2 costantemente alta il giorno 7, tempo per la risoluzione sostenuta dei sintomi e ospedalizzazione correlata a COVID, visita al pronto soccorso o morte per qualsiasi causa dal basale entro il giorno 29. Gli endpoint aggiuntivi includono il cambiamento dal basale della carica virale in altri momenti, miglioramento dei sintomi, risoluzione dei sintomi e sicurezza.
Lo studio è in corso con ulteriori bracci di trattamento.
Informazioni sull’impegno di Lilly contro il COVID-19
Lilly sta mettendo in gioco tutta la sua competenza scientifica e medica per contrastare la pandemia di coronavirus in tutto il mondo. Alcuni medicinali attualmente commercializzati di Lilly sono ora allo studio per comprenderne il potenziale nel trattamento delle complicanze di COVID-19 e l’azienda sta collaborando con due società biotecnologiche per scoprire nuovi anticorpi terapeutici per COVID-19. Lilly sta testando sia i singoli anticorpi che le combinazioni di anticorpi (a volte noti come cocktail di anticorpi) come potenziali terapie per COVID-19.
Eli Lilly and Company
Lilly è un’azienda leader a livello globale nel settore sanitario, capace di coniugare la cura dei pazienti con la ricerca al fine di migliorare la vita delle persone di tutto il mondo. Fondata oltre un secolo fa da un uomo determinato a realizzare farmaci di alta qualità che rispondessero a esigenze reali, l’azienda rimane ancora oggi fedele a questa mission in ogni sua attività. In tutto il mondo, il personale di Lilly lavora per scoprire e mettere a disposizione delle persone che ne hanno bisogno farmaci in grado di cambiare la loro vita, per ampliare le conoscenze e migliorare la gestione delle malattie, e per contribuire al benessere delle comunità attraverso attività filantropiche e di volontariato. Per ulteriori informazioni su Lilly, consultare i siti www.lilly.com e www.lilly.com/newsroom/social-channels.
Per maggiori informazioni:
Lilly
Sara Amori, Advocacy & Communication Sr. Manager – tel. 335 5951632